อิเล็กโทรลิซิส — หลักการทำงาน วัตถุประสงค์ และการนำไปใช้
กระบวนการอิเล็กโทรลิซิส
 อิเล็กโทรลิซิสแพร่หลายในโลหะวิทยาที่ไม่ใช่เหล็กและในอุตสาหกรรมเคมีจำนวนมาก โลหะ เช่น อะลูมิเนียม สังกะสี แมกนีเซียม ได้มาจากการอิเล็กโทรไลซิสเป็นส่วนใหญ่ นอกจากนี้ อิเล็กโทรลิซิสยังใช้ในการกลั่น (ทำให้บริสุทธิ์) ทองแดง นิกเกิล ตะกั่ว ตลอดจนผลิตไฮโดรเจน ออกซิเจน คลอรีน และสารเคมีอื่นๆ อีกจำนวนมาก
อิเล็กโทรลิซิสแพร่หลายในโลหะวิทยาที่ไม่ใช่เหล็กและในอุตสาหกรรมเคมีจำนวนมาก โลหะ เช่น อะลูมิเนียม สังกะสี แมกนีเซียม ได้มาจากการอิเล็กโทรไลซิสเป็นส่วนใหญ่ นอกจากนี้ อิเล็กโทรลิซิสยังใช้ในการกลั่น (ทำให้บริสุทธิ์) ทองแดง นิกเกิล ตะกั่ว ตลอดจนผลิตไฮโดรเจน ออกซิเจน คลอรีน และสารเคมีอื่นๆ อีกจำนวนมาก
สาระสำคัญของอิเล็กโทรไลซิสคือการแยกอนุภาคของสารออกจากอิเล็กโทรไลต์เมื่อกระแสตรงผ่านอ่างอิเล็กโทรไลต์และการสะสมบนอิเล็กโทรดที่แช่อยู่ในอ่าง (การสกัดด้วยไฟฟ้า) หรือเมื่อสารถูกถ่ายโอนจากอิเล็กโทรดหนึ่งผ่านอิเล็กโทรไลต์ไปยังอีกอิเล็กโทรไลต์ ( การกลั่นด้วยไฟฟ้า) ในทั้งสองกรณี เป้าหมายของกระบวนการคือการได้รับสารที่บริสุทธิ์ที่สุดเท่าที่จะเป็นไปได้ซึ่งไม่ปนเปื้อนด้วยสิ่งเจือปน
ในทางตรงกันข้าม การนำไฟฟ้า โลหะในอิเล็กโทรไลต์ (สารละลายของเกลือ กรดและเบสในน้ำ และในตัวทำละลายอื่น ๆ รวมทั้งในสารประกอบที่หลอมเหลว) จะสังเกตค่าการนำไฟฟ้าของไอออนิก
อิเล็กโทรไลต์เป็นตัวนำชั้นสองในสารละลายและของหลอมเหล่านี้ การแยกตัวด้วยไฟฟ้าจะเกิดขึ้น คือการแตกตัวของไอออนที่มีประจุบวกและประจุลบ
หากวางอิเล็กโทรดที่เชื่อมต่อกับแหล่งพลังงานไฟฟ้าไว้ในภาชนะที่มีอิเล็กโทรไลต์ - อิเล็กโทรไลเซอร์ กระแสไอออนิกจะเริ่มไหลเข้ามา และไอออนที่มีประจุบวก - ไอออนบวกจะเคลื่อนที่ไปที่แคโทด (ส่วนใหญ่เป็นโลหะและไฮโดรเจน ) และไอออนที่มีประจุลบ — แอนไอออน (คลอรีน, ออกซิเจน) — ไปยังขั้วบวก
ที่ขั้วบวก ประจุลบจะปล่อยประจุและกลายเป็นอนุภาคที่เป็นกลางซึ่งเกาะอยู่บนขั้วไฟฟ้า ที่แคโทด ไอออนบวกจะรับอิเล็กตรอนจากอิเล็กโทรดและถูกทำให้เป็นกลาง ตกตะกอนบนอิเล็กโทรด และก๊าซที่ปล่อยออกมาบนอิเล็กโทรดในรูปของฟองอากาศจะลอยขึ้น
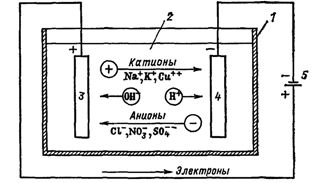
ข้าว. 1. กระบวนการระหว่างอิเล็กโทรลิซิส วงจรอาบน้ำไฟฟ้า: 1 — อ่างอาบน้ำ 2 — อิเล็กโทรไลต์ 3 — แอโนด 4 — แคโทด 5 — แหล่งจ่ายไฟ
กระแสไฟฟ้าในวงจรภายนอกคือการเคลื่อนที่ของอิเล็กตรอนจากขั้วบวกไปยังขั้วลบ (รูปที่ 1) ในกรณีนี้ สารละลายจะหมดลง และเพื่อรักษาความต่อเนื่องของกระบวนการอิเล็กโทรลิซิส จึงต้องเสริมสมรรถนะ นี่คือวิธีการสกัดสารบางชนิดออกจากอิเล็กโทรไลต์ (การสกัดด้วยไฟฟ้า)

หากอิเล็กโทรดถูกวางไว้ในสารละลายที่มีไอออนของสารชนิดเดียวกันที่ทำขึ้น ดังนั้น ณ ศักย์หนึ่งระหว่างอิเล็กโทรดกับสารละลาย อิเล็กโทรดจะไม่ละลายหรือสารจะเกาะอยู่บนสารละลาย
ศักยภาพนี้เรียกว่าศักยภาพปกติของสาร หากมีการใช้ศักย์ไฟฟ้าเชิงลบมากขึ้นกับอิเล็กโทรด การปลดปล่อยสาร (กระบวนการแคโทดิก) จะเริ่มขึ้น แต่ถ้าเป็นบวกมากขึ้น การสลายตัวของสารจะเริ่มขึ้น (กระบวนการแอโนดิก)
ค่าของศักยภาพปกติขึ้นอยู่กับความเข้มข้นของไอออนและอุณหภูมิ เป็นที่ยอมรับโดยทั่วไปในการพิจารณาว่าศักยภาพปกติของไฮโดรเจนเป็นศูนย์ ตารางที่ 1 แสดงศักยภาพของอิเล็กโทรดปกติของสารละลายที่เป็นน้ำของสารที่อุณหภูมิ + 25 องศาเซลเซียส
ตารางที่ 1 ศักย์ไฟฟ้าปกติที่ + 25 ° C
หากอิเล็กโทรไลต์ประกอบด้วยไอออนของโลหะต่างชนิดกัน ไอออนที่มีศักย์ไฟฟ้าปกติเป็นลบต่ำกว่า (ทองแดง เงิน ตะกั่ว นิกเกิล) จะถูกแยกออกก่อนที่แคโทด โลหะอัลคาไลน์เอิร์ธเป็นสิ่งที่แยกได้ยากที่สุด นอกจากนี้ยังมีไฮโดรเจนไอออนในสารละลายที่เป็นน้ำเสมอ ซึ่งจะปล่อยออกมาเร็วกว่าโลหะทุกชนิดที่มีค่าศักย์ไฟฟ้าปกติเป็นลบ ดังนั้นในระหว่างการอิเล็กโทรลิซิสของอิเล็กโทรลิซิส พลังงานส่วนใหญ่หรือแม้แต่ส่วนใหญ่จะถูกใช้ในการปลดปล่อยไฮโดรเจน .
ด้วยความช่วยเหลือของมาตรการพิเศษ จึงเป็นไปได้ที่จะป้องกันการวิวัฒนาการของไฮโดรเจนภายในขอบเขตที่กำหนด แต่โลหะที่มีศักยภาพปกติน้อยกว่า 1 V (เช่น แมกนีเซียม อะลูมิเนียม โลหะอัลคาไลน์เอิร์ท) ไม่สามารถรับได้โดยอิเล็กโทรลิซิสจาก สารละลายน้ำ ได้มาจากการสลายตัวของเกลือหลอมเหลวของโลหะเหล่านี้
ศักย์ไฟฟ้าปกติของสารที่ระบุในตาราง1 มีค่าน้อยที่สุดที่กระบวนการอิเล็กโทรลิซิสเริ่มต้นขึ้น ในทางปฏิบัติ ค่าศักยภาพจำนวนมากจำเป็นสำหรับการพัฒนากระบวนการ
ความแตกต่างระหว่างศักย์จริงของอิเล็กโทรดระหว่างอิเล็กโทรไลซิสกับศักย์ปกติเรียกว่า แรงดันไฟเกิน จะเพิ่มการสูญเสียพลังงานในระหว่างการอิเล็กโทรไลซิส
ในทางกลับกัน การเพิ่มแรงดันไฟฟ้าเกินสำหรับไฮโดรเจนไอออนทำให้ยากต่อการปลดปล่อยไอออนที่แคโทด ซึ่งทำให้สามารถรับโลหะจำนวนหนึ่งที่มีประจุลบมากกว่าไฮโดรเจนได้ด้วยอิเล็กโทรลิซิส เช่น ตะกั่ว ดีบุก นิกเกิล โคบอลต์ โครเมียม และแม้แต่สังกะสี สิ่งนี้ทำได้โดยการดำเนินกระบวนการที่ความหนาแน่นกระแสไฟฟ้าที่เพิ่มขึ้นบนอิเล็กโทรด รวมทั้งโดยการใส่สารบางอย่างเข้าไปในอิเล็กโทรไลต์
การเกิดปฏิกิริยาแคโทดิกและแอโนดิกระหว่างอิเล็กโทรไลซิสถูกกำหนดโดยกฎสองข้อต่อไปนี้ของฟาราเดย์
1. มวลของสาร md ที่ปล่อยออกมาในระหว่างการอิเล็กโทรไลซิสในแคโทดหรือผ่านจากแอโนดไปยังอิเล็กโทรไลต์นั้นเป็นสัดส่วนกับปริมาณไฟฟ้าที่ผ่านอิเล็กโทรไลต์ Azτ: me = α/τ, a คือค่าสมมูลทางเคมีไฟฟ้าของสาร , กรัม/ซี.
2. มวลของสารที่ปล่อยออกมาในระหว่างการอิเล็กโทรลิซิสด้วยไฟฟ้าในปริมาณที่เท่ากันนั้นเป็นสัดส่วนโดยตรงกับมวลอะตอมของสาร A และแปรผกผันกับความจุของมัน n: mNS = A / 96480n ที่นี่ 96480 คือหมายเลขฟาราเดย์ C x โมล -1 .
ด้วยวิธีนี้ ค่าสมมูลทางเคมีไฟฟ้าของสาร α= A / 96480n แสดงถึงมวลของสารในหน่วยกรัมที่ปล่อยออกมาจากปริมาณไฟฟ้าหนึ่งหน่วยที่ไหลผ่านอ่างอิเล็กโทรไลต์ ซึ่งก็คือคูลอมบ์ (แอมแปร์-วินาที)
สำหรับทองแดง A = 63.54, n =2, α =63.54/96480-2= 0.000329 g / C สำหรับนิกเกิล α =0.000304 g / C สำหรับสังกะสี α = 0.00034 g / C

อัตราส่วนของมวลของสารที่ปล่อยออกมาจริงต่อมวลที่ควรได้รับการปลดปล่อยตามกฎของคูลอมบ์เรียกว่าผลผลิตปัจจุบันของสาร η1
ดังนั้นสำหรับกระบวนการจริง mNS = η1 NS (A / 96480n) NS มัน
โดยธรรมชาติแล้ว η1 เสมอ
ประสิทธิภาพปัจจุบันขึ้นอยู่กับความหนาแน่นกระแสของอิเล็กโทรดอย่างมีนัยสำคัญ เมื่อความหนาแน่นกระแสไฟฟ้าของอิเล็กโทรดเพิ่มขึ้น ประสิทธิภาพในปัจจุบันจะเพิ่มขึ้นและประสิทธิภาพของกระบวนการจะเพิ่มขึ้น
แรงดันไฟฟ้า Uel ที่ต้องจ่ายให้กับอิเล็กโทรไลเซอร์ประกอบด้วย: แรงดันพังทลาย Ep (ความต่างศักย์ของปฏิกิริยาแอโนดิกและแคโทด), ผลรวมของแรงดันเกินแอโนดิกและแคโทด, แรงดันตกในอิเล็กโทรไลต์ Ep, แรงดันตกในอิเล็กโทรไลต์ Ue = IRep (Rep — ความต้านทานไฟฟ้า), แรงดันตกในยาง, หน้าสัมผัส, อิเล็กโทรด Uc = I(Rw +Rto +RNS) เราได้รับ: Uel = Ep + Ep + Ue + Us
พลังงานที่ใช้ระหว่างอิเล็กโทรลิซิสเท่ากับ: Rel = IUmail = I(Ep + Ep + Ue + Uc)
จากพลังงานนี้ ส่วนประกอบแรกเท่านั้นที่ใช้สำหรับการทำปฏิกิริยา ส่วนที่เหลือคือการสูญเสียความร้อนของกระบวนการ เฉพาะในระหว่างการอิเล็กโทรไลซิสของเกลือที่หลอมเหลวเท่านั้น ความร้อนส่วนหนึ่งที่ปล่อยออกมาในอิเล็กโทรไลต์ IUe จะถูกนำมาใช้อย่างเป็นประโยชน์ เนื่องจากใช้ไปกับการละลายเกลือที่ประจุอยู่ในอิเล็กโทรไลเซอร์
ประสิทธิภาพของอ่างอิเล็กโทรลิซิสสามารถประเมินได้จากมวลของสารในหน่วยกรัมที่ปล่อยออกมาต่อ 1 J ของไฟฟ้าที่ใช้ค่านี้เรียกว่าผลผลิตพลังงานของสสาร หาได้จากนิพจน์ qe = (αη1) /Uel100 ในที่นี้ α — ค่าสมมูลทางเคมีไฟฟ้าของสาร, g / C, η1 — เอาท์พุตกระแส, Uemail — แรงดันของอิเล็กโทรไลต์ เซลล์, วี.