วิธีการทำงานของแบตเตอรี่และการทำงาน
 ในความหมายที่กว้างที่สุดของคำในเทคโนโลยี คำว่า "แบตเตอรี่" หมายถึงอุปกรณ์ที่อนุญาตให้สะสมพลังงานบางประเภทภายใต้สภาวะการทำงานบางอย่าง และในความหมายอื่นๆ เพื่อใช้ตามความต้องการของมนุษย์
ในความหมายที่กว้างที่สุดของคำในเทคโนโลยี คำว่า "แบตเตอรี่" หมายถึงอุปกรณ์ที่อนุญาตให้สะสมพลังงานบางประเภทภายใต้สภาวะการทำงานบางอย่าง และในความหมายอื่นๆ เพื่อใช้ตามความต้องการของมนุษย์
พวกมันถูกใช้เมื่อจำเป็นต้องรวบรวมพลังงานในช่วงเวลาหนึ่ง จากนั้นใช้มันเพื่อดำเนินกระบวนการที่ต้องใช้แรงงานจำนวนมาก ตัวอย่างเช่น ตัวสะสมไฮดรอลิกที่ใช้ในแม่กุญแจช่วยให้เรือสามารถขึ้นสู่ระดับใหม่บนพื้นแม่น้ำได้
แบตเตอรี่ไฟฟ้าทำงานร่วมกับไฟฟ้าด้วยหลักการเดียวกัน ประการแรก แบตเตอรี่จะสะสม (สะสม) ไฟฟ้าจากแหล่งชาร์จภายนอก จากนั้นจึงจ่ายให้กับผู้บริโภคที่เชื่อมต่ออยู่เพื่อทำงาน โดยธรรมชาติแล้วพวกมันอยู่ในแหล่งกระแสเคมีที่สามารถดำเนินการปล่อยและชาร์จซ้ำเป็นระยะ
ระหว่างการทำงาน ปฏิกิริยาเคมีจะเกิดขึ้นอย่างต่อเนื่องระหว่างส่วนประกอบของแผ่นอิเล็กโทรดกับสารเติมอิเล็กโทรไลต์
แผนภาพแผนผังของอุปกรณ์แบตเตอรี่สามารถแสดงได้ด้วยการวาดแบบง่ายเมื่อใส่แผ่นโลหะสองแผ่นที่มีลวดต่างกันเข้าไปในตัวเรือเพื่อให้หน้าสัมผัสทางไฟฟ้า อิเล็กโทรไลต์ถูกเทลงระหว่างจาน
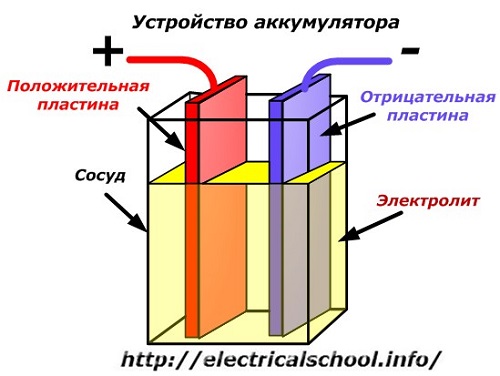
การทำงานของแบตเตอรี่เมื่อคายประจุ
เมื่อโหลด เช่น หลอดไฟ เชื่อมต่อกับอิเล็กโทรด วงจรไฟฟ้าแบบปิดจะถูกสร้างขึ้นโดยกระแสดิสชาร์จจะไหลผ่าน เกิดจากการเคลื่อนที่ของอิเล็กตรอนในชิ้นส่วนโลหะและไอออนบวกในอิเล็กโทรไลต์
กระบวนการนี้แสดงตามอัตภาพบนไดอะแกรมที่มีการออกแบบอิเล็กโทรดนิกเกิล-แคดเมียม
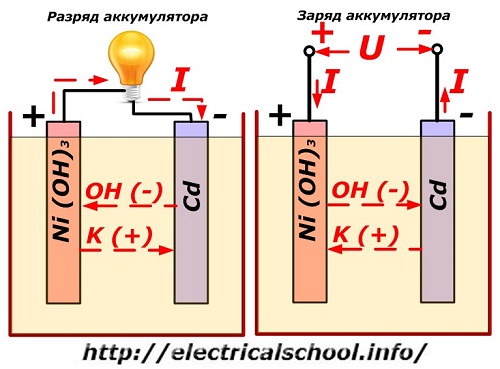
ที่นี่ มีการใช้นิกเกิลออกไซด์กับสารเติมแต่งกราไฟต์ซึ่งช่วยเพิ่มการนำไฟฟ้า เป็นวัสดุของอิเล็กโทรดขั้วบวก โลหะของขั้วลบคือแคดเมียมที่เป็นรูพรุน
ในระหว่างการคายประจุ อนุภาคแอคทีฟออกซิเจนจากนิกเกิลออกไซด์จะถูกปล่อยเข้าไปในอิเล็กโทรไลต์และพุ่งตรงไปยังแผ่นประจุลบ ซึ่งแคดเมียมจะถูกออกซิไดซ์
ประสิทธิภาพของแบตเตอรี่เมื่อทำการชาร์จ
เมื่อปิดโหลด แรงดันไฟฟ้าคงที่ (ในบางสถานการณ์ การเต้นเป็นจังหวะ) จะถูกนำไปใช้กับขั้วของเพลทที่มีค่ามากกว่าของแบตเตอรี่ที่ชาร์จแล้วซึ่งมีขั้วเดียวกัน เมื่อขั้วบวกและลบของแหล่งที่มาและผู้บริโภคตรงกัน .
เครื่องชาร์จมีกำลังไฟมากกว่าเสมอ ซึ่งจะ "ยับยั้ง" พลังงานที่เหลืออยู่ในแบตเตอรี่ และสร้างกระแสไฟฟ้าในทิศทางตรงกันข้ามกับการคายประจุ เป็นผลให้กระบวนการทางเคมีภายในระหว่างอิเล็กโทรดและอิเล็กโทรไลต์เปลี่ยนไป ตัวอย่างเช่น บนกล่องแผ่นนิกเกิลแคดเมียม อิเล็กโทรดบวกจะอุดมด้วยออกซิเจน และขั้วลบจะอยู่ในสถานะของแคดเมียมบริสุทธิ์
เมื่อแบตเตอรี่หมดและถูกชาร์จ องค์ประกอบทางเคมีของวัสดุของแผ่น (อิเล็กโทรด) จะเปลี่ยนไป แต่อิเล็กโทรไลต์จะไม่เปลี่ยนแปลง
วิธีการเชื่อมต่อแบตเตอรี่
การเชื่อมต่อแบบขนาน
ปริมาณกระแสไฟฟ้าที่บุคคลสามารถทนได้นั้นขึ้นอยู่กับหลายปัจจัย แต่โดยหลักแล้วอยู่ที่การออกแบบ วัสดุที่ใช้ และขนาด ยิ่งพื้นที่ของแผ่นอิเล็กโทรดมีขนาดใหญ่เท่าใดก็จะยิ่งสามารถทนกระแสได้มากขึ้นเท่านั้น
หลักการนี้ใช้เพื่อเชื่อมต่อเซลล์ประเภทเดียวกันแบบขนานในแบตเตอรี่เมื่อจำเป็นต้องเพิ่มกระแสให้กับโหลดแต่ในการชาร์จการออกแบบดังกล่าวจำเป็นต้องเพิ่มพลังงานของแหล่งจ่าย วิธีนี้ไม่ค่อยได้ใช้สำหรับโครงสร้างสำเร็จรูปเนื่องจากตอนนี้การซื้อแบตเตอรี่ที่จำเป็นจะทำได้ง่ายกว่ามาก แต่ผู้ผลิตแบตเตอรี่กรดใช้มันโดยเชื่อมต่อแผ่นต่าง ๆ เข้าด้วยกันเป็นก้อนเดียว
การเชื่อมต่อแบบอนุกรม
ขึ้นอยู่กับวัสดุที่ใช้ สามารถสร้างแรงดันไฟฟ้า 1.2 / 1.5 หรือ 2.0 โวลต์ระหว่างแผ่นอิเล็กโทรดสองแผ่นของแบตเตอรี่ทั่วไปในชีวิตประจำวัน (อันที่จริงช่วงนี้กว้างกว่ามาก) แน่นอนว่าไม่เพียงพอสำหรับอุปกรณ์ไฟฟ้าจำนวนมาก ดังนั้นแบตเตอรี่ประเภทเดียวกันจึงเชื่อมต่อเป็นอนุกรมและมักจะทำในกรณีเดียว
ตัวอย่างของการออกแบบดังกล่าวคือการพัฒนายานยนต์อย่างแพร่หลายโดยใช้กรดซัลฟิวริกและแผ่นอิเล็กโทรดตะกั่ว
โดยปกติแล้วในหมู่ผู้คนโดยเฉพาะอย่างยิ่งในหมู่คนขับรถขนส่งเป็นเรื่องปกติที่จะเรียกอุปกรณ์ใด ๆ ว่าแบตเตอรี่โดยไม่คำนึงถึงจำนวนองค์ประกอบที่เป็นส่วนประกอบ - กล่อง อย่างไรก็ตาม สิ่งนี้ไม่ถูกต้องทั้งหมดโครงสร้างที่ประกอบจากกล่องหลายกล่องที่ต่อเป็นชุดเป็นแบตเตอรี่อยู่แล้ว ซึ่งมีชื่อย่อว่า «АКБ» ติดอยู่... โครงสร้างภายในจะแสดงในรูป
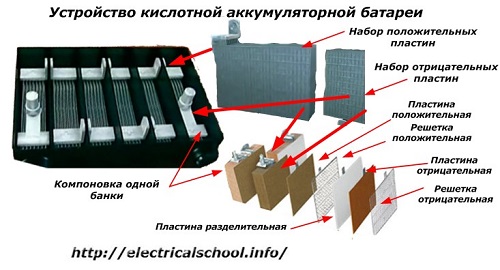
ไหแต่ละอันประกอบด้วยสองบล็อกพร้อมชุดจานสำหรับขั้วไฟฟ้าบวกและลบ บล็อกประกอบเข้าด้วยกันโดยไม่ต้องสัมผัสโลหะและมีความเป็นไปได้ในการเชื่อมต่อไฟฟ้าที่เชื่อถือได้ผ่านอิเล็กโทรไลต์
ในกรณีนี้ แผ่นสัมผัสมีตะแกรงเพิ่มเติมและแยกออกจากกันด้วยแผ่นคั่น
การเชื่อมต่อแผ่นในบล็อกจะเพิ่มพื้นที่ทำงาน ลดความต้านทานรวมของโครงสร้างทั้งหมด และช่วยให้คุณเพิ่มกำลังของโหลดที่เชื่อมต่อ
ภายนอกกล่องแบตเตอรี่ดังกล่าวมีองค์ประกอบตามรูปด้านล่าง
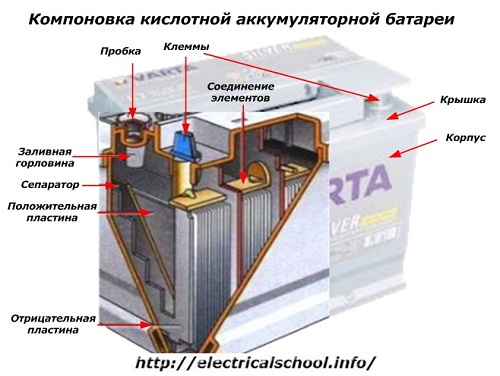
แสดงให้เห็นว่าตัวเรือนพลาสติกที่ทนทานถูกซีลด้วยฝาปิดและติดตั้งขั้วต่อ 2 ขั้ว (โดยปกติจะเป็นรูปทรงกรวย) ที่ด้านบนสำหรับเชื่อมต่อกับวงจรไฟฟ้าของรถ เครื่องหมายขั้วถูกประทับบนขั้ว: «+» และ «-« โดยปกติแล้ว ขั้วบวกจะมีเส้นผ่านศูนย์กลางใหญ่กว่าขั้วลบเล็กน้อยเพื่อป้องกันข้อผิดพลาดในการเดินสาย
แบตเตอรี่ที่ซ่อมบำรุงได้จะมีรูเติมที่ด้านบนของโถแต่ละอันเพื่อควบคุมระดับอิเล็กโทรไลต์หรือเติมน้ำกลั่นระหว่างการทำงาน ปลั๊กถูกขันเข้าที่ซึ่งช่วยป้องกันโพรงภายในของเคสจากการปนเปื้อนและในขณะเดียวกันก็ป้องกันอิเล็กโทรไลต์ไม่ให้หกเมื่อเอียงแบตเตอรี่
เนื่องจากมีประจุไฟฟ้าที่ทรงพลัง จึงสามารถเกิดแก๊สจากอิเล็กโทรไลต์ได้ (และกระบวนการนี้เกิดขึ้นได้ในระหว่างการขับขี่อย่างเข้มข้น) จึงมีการเจาะรูที่ปลั๊กเพื่อป้องกันไม่ให้แรงดันภายในกล่องเพิ่มขึ้นออกซิเจนและไฮโดรเจนรวมถึงไอระเหยของอิเล็กโทรไลต์จะออกจากพวกมัน ขอแนะนำให้หลีกเลี่ยงสถานการณ์ที่เกี่ยวข้องกับกระแสชาร์จมากเกินไป
รูปเดียวกันนี้แสดงการเชื่อมต่อขององค์ประกอบระหว่างฝั่งและการจัดเรียงของแผ่นอิเล็กโทรด
แบตเตอรี่สตาร์ทรถยนต์ (กรดตะกั่ว) ทำงานบนหลักการของซัลเฟตสองเท่า ในระหว่างการคายประจุ / การชาร์จ กระบวนการทางเคมีไฟฟ้าจะเกิดขึ้นพร้อมกับการเปลี่ยนแปลงองค์ประกอบทางเคมีของมวลที่ใช้งานของอิเล็กโทรดด้วยการปล่อย / การดูดซึมน้ำในอิเล็กโทรไลต์ (กรดซัลฟิวริก)
สิ่งนี้อธิบายถึงการเพิ่มขึ้นของความถ่วงจำเพาะของอิเล็กโทรไลต์เมื่อทำการชาร์จและการลดลงเมื่อแบตเตอรี่หมด กล่าวอีกนัยหนึ่ง ค่าความหนาแน่นทำให้คุณสามารถประเมินสภาพไฟฟ้าของแบตเตอรี่ได้ ใช้อุปกรณ์พิเศษในการวัด - ไฮโดรมิเตอร์ในรถยนต์
น้ำกลั่นซึ่งเป็นส่วนหนึ่งของอิเล็กโทรไลต์ของแบตเตอรี่กรดจะเปลี่ยนสถานะเป็นของแข็ง - น้ำแข็งที่อุณหภูมิติดลบ ดังนั้น เพื่อป้องกันไม่ให้แบตเตอรี่รถยนต์แข็งตัวในสภาพอากาศหนาวเย็นจึงจำเป็นต้องใช้มาตรการพิเศษที่กำหนดไว้ในกฎ เพื่อการแสวงประโยชน์
มีแบตเตอรี่ประเภทใดบ้าง?
การผลิตสมัยใหม่เพื่อวัตถุประสงค์ต่างๆ ทำให้เกิดผลิตภัณฑ์มากกว่าสามโหลที่มีส่วนประกอบของอิเล็กโทรดและอิเล็กโทรไลต์ต่างกัน 12 รุ่นที่รู้จักทำงานบนลิเธียมเท่านั้น

สามารถพบสิ่งต่อไปนี้เป็นโลหะอิเล็กโทรด:
-
ตะกั่ว;
-
เหล็ก;
-
ลิเธียม;
-
ไทเทเนียม;
-
โคบอลต์;
-
แคดเมียม;
-
นิกเกิล;
-
สังกะสี;
-
เงิน;
-
วานาเดียม;
-
อลูมิเนียม
-
บางรายการอื่น ๆ
สิ่งเหล่านี้ส่งผลต่อลักษณะเอาต์พุตทางไฟฟ้าและการใช้งาน
ความสามารถในการทนต่อภาระสูงในระยะสั้นซึ่งเป็นผลมาจากการหมุนของเพลาข้อเหวี่ยงของเครื่องยนต์สันดาปภายในโดยมอเตอร์สตาร์ทไฟฟ้าเป็นลักษณะของแบตเตอรี่ตะกั่วกรด มีการใช้กันอย่างแพร่หลายในการขนส่ง เครื่องสำรองไฟฟ้า และระบบไฟฟ้าฉุกเฉิน
มาตรฐาน เซลล์กัลวานิก (แบตเตอรี่ทั่วไป) มักจะถูกแทนที่ด้วยแบตเตอรี่นิกเกิล-แคดเมียม นิกเกิล-สังกะสี และนิกเกิล-เมทัลไฮไดรด์
แต่การออกแบบลิเธียมไอออนหรือลิเธียมโพลิเมอร์ทำงานได้อย่างน่าเชื่อถือในอุปกรณ์เคลื่อนที่และคอมพิวเตอร์ เครื่องมือก่อสร้าง และแม้แต่ยานพาหนะไฟฟ้า
ตามประเภทของอิเล็กโทรไลต์ที่ใช้ แบตเตอรี่มีดังนี้
-
เปรี้ยว
-
อัลคาไลน์
มีการแบ่งประเภทของแบตเตอรี่ตามวัตถุประสงค์ ตัวอย่างเช่นในสภาพปัจจุบันอุปกรณ์ที่ใช้สำหรับการถ่ายโอนพลังงานปรากฏขึ้น - ชาร์จแหล่งอื่น แบตเตอรี่ภายนอกที่เรียกว่าช่วยให้เจ้าของอุปกรณ์พกพาจำนวนมากในกรณีที่ไม่มีเครือข่ายไฟฟ้าสำรอง สามารถชาร์จแท็บเล็ต สมาร์ทโฟน โทรศัพท์มือถือซ้ำได้
แบตเตอรี่เหล่านี้มีหลักการทำงานเหมือนกันและอุปกรณ์ที่คล้ายกัน ตัวอย่างเช่น โมเดลนิ้วลิเธียมไอออนที่แสดงในรูปด้านล่างในหลายๆ รูปแบบซ้ำกับการออกแบบของแบตเตอรี่กรดที่กล่าวถึงก่อนหน้านี้
ที่นี่เราเห็นอิเล็กโทรดแบบสัมผัส แผ่น ตัวคั่น และตัวเรือนแบบเดียวกัน เฉพาะพวกเขาเท่านั้นที่คำนึงถึงสภาพการทำงานอื่น ๆ
คุณสมบัติทางไฟฟ้าพื้นฐานของแบตเตอรี่
การทำงานของอุปกรณ์ได้รับผลกระทบจากพารามิเตอร์:
-
ความจุ;
-
ความหนาแน่นของพลังงาน
-
ปลดปล่อยตัวเอง;
-
ระบอบอุณหภูมิ
ความจุเรียกว่าการชาร์จสูงสุดของแบตเตอรี่ซึ่งสามารถจ่ายให้กับแรงดันไฟฟ้าต่ำสุดได้ในระหว่างการคายประจุ แสดงเป็นจี้ (ระบบ SI) และแอมแปร์-ชั่วโมง (หน่วยที่ไม่ใช่ระบบ)
ความจุประเภทหนึ่งคือ «ความจุพลังงาน» ซึ่งจะกำหนดพลังงานที่ปล่อยออกมาระหว่างการคายประจุไปจนถึงแรงดันไฟฟ้าขั้นต่ำที่อนุญาต มีหน่วยวัดเป็นจูล (SI) และวัตต์-ชั่วโมง (หน่วยที่ไม่ใช่ SI)
ความหนาแน่นของพลังงานแสดงเป็นอัตราส่วนของปริมาณพลังงานต่อน้ำหนักหรือปริมาตรของแบตเตอรี่
การคายประจุเองจะพิจารณาถึงการสูญเสียความจุหลังจากการชาร์จในกรณีที่ไม่มีโหลดที่ขั้ว ทั้งนี้ขึ้นอยู่กับการออกแบบ และอาจรุนแรงขึ้นจากการพังทลายของฉนวนระหว่างอิเล็กโทรดด้วยเหตุผลหลายประการ
อุณหภูมิในการทำงานส่งผลต่อคุณสมบัติทางไฟฟ้าและในกรณีที่มีการเบี่ยงเบนอย่างร้ายแรงจากบรรทัดฐานที่ระบุโดยผู้ผลิต อาจทำให้แบตเตอรี่เสียหายได้ ความร้อนและความเย็นเป็นสิ่งที่ยอมรับไม่ได้ ส่งผลต่อปฏิกิริยาเคมีและความดันของสิ่งแวดล้อมภายในกล่อง
